
2022年4月4日,Signal Transduction and Targeted Therapy杂志刊发了华西第二医院贾大研究员关于靶向蛋白降解药物的文章,总结了靶向蛋白降解药物的原理、开发策略及应用场景。本文主要结合贾大研究员的综述文章及相关公开资料对靶向蛋白降解技术进行梳理和总结。
靶向蛋白质降解(TPD)目前主要通过泛素蛋白酶体和溶酶体降解目标蛋白,根据具体作用原理又可细分为近10个不同技术路线,其中发展最快的是分子胶和PROTAC技术,BMS的分子胶来那度胺年销售额已达128.91亿美元,Arvinas的PROTAC分子ARV-471今年将启动III期临床,基于溶酶体的靶向降解发展时间较短,目前仍处于临床前阶段。在常规靶点开发殆尽、新靶点发现难度高的药物开发现状下,TPD技术为药物开发提供了新路径,大大拓宽了可靶向的蛋白范围,将是未来最具发展潜力的技术之一。
TPD细分技术梳理
在真核细胞中,受损的蛋白质或细胞器主要通过两条相互独立,但又相互关联的途径进行清除,即蛋白酶体途径和溶酶体途径。一般来说,蛋白酶体通过泛素-蛋白酶体系统降解短寿命蛋白和可溶性错误折叠的蛋白,而溶酶体则通过内吞、吞噬或自噬途径降解长寿命蛋白、不溶性蛋白聚集体,以及其他大分子化合物和细菌、细胞器等。
泛素-蛋白酶体降解系统[1]
泛素-蛋白酶体系统(Ubiquitin-proteasome System, UPS)是人体细胞内重要的蛋白降解途径之一,在DNA修复、信号传导、转录翻译、免疫应答等多种细胞活动中起重要作用。该系统主要元件包括泛素(Ub)、泛素活化酶E1、泛素结合酶E2以及泛素连接酶E3、去泛素化酶(DUB)以及26S蛋白酶体。在泛素酶E1、E2、E3的级联催化下,泛素分子可以共价结合到底物蛋白的赖氨酸残基上,使该底物蛋白带上一个或多个泛素标记。泛素化标记后的蛋白能够被26S蛋白酶体识别并降解,或者是被去泛素化酶解除泛素标记。
溶酶体降解系统[11]
溶酶体是一种酸性细胞器,通过内吞、吞噬和自噬作用从质膜或细胞质中接收物质,并将其降解和循环利用,也可消化细胞自身的局部细胞质或细胞器,通过溶酶体调节细胞内物质水平对于维持正常的代谢活动具有重要意义。溶酶体主要通过三种途径进行蛋白降解:①细胞表面蛋白经过内吞作用到达内体(endosome),之后再被溶酶体降解,或运输到质膜或其他细胞器进行回收;②细胞吞噬入侵的病原体、死细胞等胞外大颗粒,形成吞噬泡(phagophore)运送到溶酶体中被降解;③错误折叠或聚集的蛋白质、受损的细胞器和细胞内病原体形成自噬小体(autophagosome)后运送到溶酶体被降解。大多数疾病都与蛋白的表达异常有关,通过蛋白酶体和溶酶体途径的靶向蛋白质降解(Targeted Protein Degradation, TPD)代表了一类针对多种疾病的极具潜力的新干预方法,近十年来得到了迅猛发展。TPD的概念最早于1999年首次提出,哈佛大学的Craig Crews则在2001年提出了更为具体的PROTAC概念,合成了第一个靶向蛋白降解的嵌合分子,可诱导蛋氨酸氨基肽酶(MetAP2)的泛素化和降解,并于2013年创立了PAOTAC领域的第一家上市公司Arvinas。此后,TPD领域又发展出了分子胶、降解标签(dTAGs)、溶酶体靶向嵌合体(LYTAC)、自噬小体绑定化合物(ATTEC)等技术,大大拓展了可降解的底物范围。
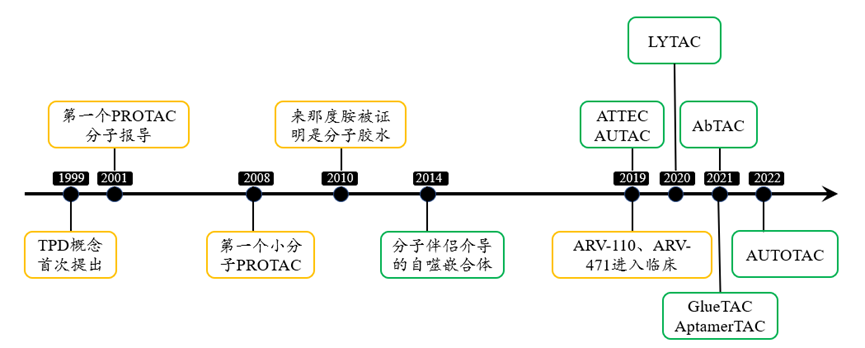
TPD技术发展史[3]
在经典泛素化途径中,泛素在E1、E2、E3酶的级联催化下结合到底物蛋白上。其中E3连接酶在底物蛋白的特异性识别以及泛素化系统活性的调控中起着最重要的作用,并且其家族数量大大超过E1和E2,人基因组编码了超过600种E3连接酶,目前基于泛素蛋白酶体系统的TPD策略均通过靶向E3连接酶发挥作用。
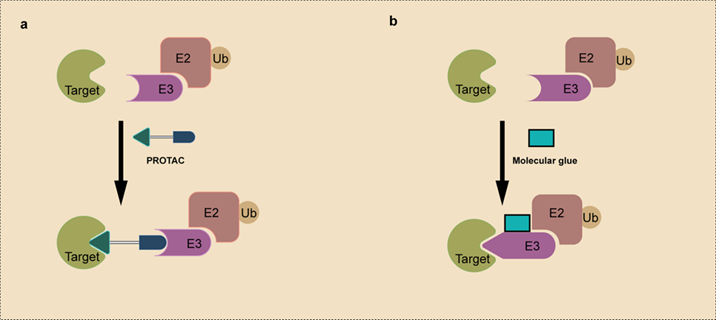
a)PROTAC b)分子胶[2]
蛋白降解靶向嵌合体(Proteolysis Targeting Chimeras, PROTAC)由能招募E3连接酶的配体、能与目标蛋白(Protein of Interest, POI)结合的配体以及连接前述两个配体的linker组成。PROTAC能够招募E3连接酶与目标蛋白,使目标蛋白泛素化之后被蛋白酶体识别并降解,目前已有包括激酶、核受体、表观遗相关靶点在内的超过100种靶蛋白被成功降解。PROTAC是开发进度最快的TPD技术,最高进度已到临床二期,目有超过20个PAOTAC进入临床,探索用于前列腺癌、B细胞淋巴瘤、乳腺癌等疾病的治疗。与传统的小分子抑制剂相比,PROTAC具有多种优势:①极大地扩展了可成药蛋白靶点的范围。目前已鉴定出超过4000种疾病相关蛋白但只有约10%被成功开发,许多蛋白由于结构复杂、没有活性位点等原因无法被传统抑制剂靶向,而PROTAC只要能结合目标蛋白就可以诱导降解,可大大拓展可成药靶点的范围。②传统小分子抑制剂只能阻断靶蛋白的部分功能,而PROTACs降解靶蛋白后可消除其所有功能。③传统的激酶抑制剂容易因靶蛋白突变或过度上调而耐药,但PROTAC可通过降解靶蛋白来最大限度减少潜在的耐药性。④PROTAC理论上是可以循环使用的,因此催化剂量即可发挥作用,可提高药物的安全性。相比PROTAC,分子胶(Molecular Glue)化学结构简单得多,其主要诱导E3连接酶和目标蛋白之间的蛋白蛋白相互作用,形成三元复合物,从而使目标蛋白泛素化并被蛋白酶体降解,而PROTAC则是诱导E3连接酶和目标蛋白接近,少数情况下会诱导形成蛋白蛋白相互作用。分子胶分子量小很多,空间干扰少,成药性更好,但分子胶无法像PROTAC那样通过对各组分的大规模筛选来获得,它的设计比PROTAC难的多。已有分子胶的药物上市,如用于骨髓瘤治疗的来那度胺和泊马度胺,二者在2021年的销售额合计超过150亿美元。双机制降解剂(Double-mechanism degrader)则是单一分子可分别扮演PROTAC和分子胶的角色,诱导两种目标蛋白的降解,有提升治疗效果的潜力。清华大学药学院的饶燏教授团队开发了一种代号GBD-9的小分子,其可以作为PROTAC促进BTK降解,也可以作为分子胶促进翻译终止因子GSPT1的降解。在多种癌细胞系中显示出比小分子BTK抑制剂依鲁替尼更强的抗肿瘤作用,有可能克服BTK抑制剂无法治疗的弥漫性大B细胞淋巴瘤以及急性髓细胞白血病。溶酶体通过内吞、吞噬和自噬作用介导蛋白和细胞器的降解。随着对内体-溶酶体和自噬体-溶酶体降解途径的深入研究,近年来不断有通过溶酶体途径的TPD技术被开发出来,如LYTAC、AbTAC、ATTEC、AUTAC、AUTOTAC等。相比基于泛素-蛋白酶体的TPD,基于溶酶体的TPD不仅可以降解胞内蛋白,还可以降解蛋白聚集体、损伤的细胞器以及细胞外蛋白,在应用场景上有更广泛的潜力。
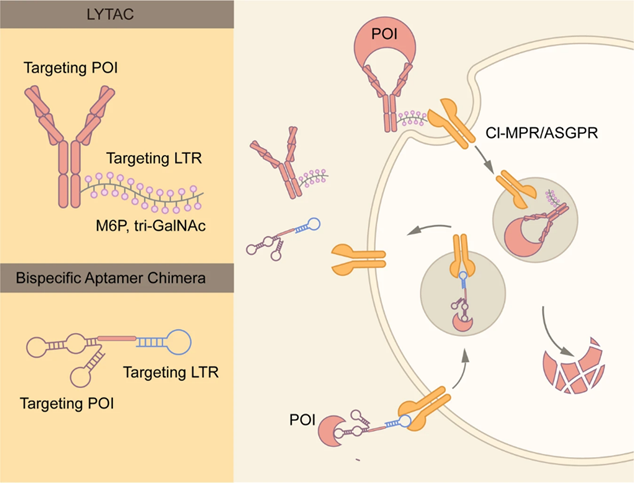
LYTAC和双特异性核酸适体嵌合体[2]
溶酶体靶向嵌合体(Lysosome-targeting chimaeras, LYTAC)通过内体-溶酶体途径诱导细胞外和膜蛋白的降解,由于细胞外蛋白和膜蛋白占编码蛋白的40%,并且是神经退行性疾病、自身免疫性疾病和癌症的关键因素,因此LYTAC可弥补PROTAC在目标蛋白和适应症上的不足。LYTAC主要由两个部分组成,一个是靶向细胞表面的溶酶体靶向受体(LTR)的寡聚糖结构(如6-磷酸甘露糖M6P及N-乙酰半乳糖胺GalNAc),另一个是靶向目标蛋白的抗体、多肽或小分子。靶向目标蛋白的配体可与目标蛋白结合,与此同时寡糖结合细胞表面的LTR(如甘露糖-6-磷酸受体CI-M6PR和去唾液酸糖蛋白受体ASGPR),三者形成LTR-LYTAC-目标蛋白三元复合物;复合物经内吞作用进入胞内,然后运送到早期内体中;随着内体酸化,三元复合物中的LTR解离并回到细胞膜或高尔基体,LYTAC与靶蛋白的复合物被继续转运至溶酶体中降解。第一个报道的LYTAC分子由斯坦福大学的Carolyn RBertozzi教授开发,其将多聚甘露糖6-磷酸共价结合到西妥昔单抗,可特异性降解多种细胞系中的EGFR。LYTAC技术的优势在于除可降解胞内蛋白外还可降解胞外蛋白和膜蛋白,应用前景广阔,但目前还需解决分子中的抗体或寡糖存在较强免疫原性、寡糖与抗体偶联时剂量比与连接位点不确定、体内清除率较高等难题。双特异性核酸适体嵌合体(Bispecific aptamer chimera)和LYTAC类似,也通过内体-溶酶体途径介导目标蛋白降解。但其化学本质与LYTAC不同,其由两个分别靶向目标蛋白和LTR的核酸适体偶联得到,也是通过与LTR及目标蛋白形成三元复合物内吞来降解目标蛋白。上海交通大学的韩达报道了第一个双特异性核酸适体嵌合体,实现了对间质表皮转化因子c-Met和酪氨酸蛋白激酶7的快速降解,在抗肿瘤方面有较好的开发潜力。相较于LYTAC,双特异性核酸适体嵌合体有制备更为简单、连接方式确定、稳定性更好的优点。
AbTAC[2]
基于抗体的PROTAC(Antibody-based PROTAC, AbTAC)也通过内体-溶酶体途径诱导胞外蛋白和膜蛋白的降解。AbTAC虽然冠PROTAC之名,但与LYTAC的关系更为密切。AbTAC本质上是一个重组的双特异性抗体,一个臂靶向细胞表面的目标蛋白,一个臂靶向跨膜的E3连接酶,例如RNF43(RNF43是一个单次跨膜的E3连接酶,包含膜外结构域,跨膜结构域和RING细胞内结构域),从而引起三元复合物的内吞和溶酶体降解。第一个AbTAC由加州大学旧金山分校的James A. Wells教授开发,通过重组双特异性抗体成功将肿瘤细胞表面的PD-L1分子成功引导到溶酶体降解。相对LYTAC,AbTAC能降低嵌合体分子的免疫原性,但其是否可以回收再利用等具体机制还有待研究。
GlueTAC[2]
基于共价抗体的PROTAC(Covalent Nanobody-BasedPROTAC, GlueTAC)由经非天然氨基酸修饰可共价结合目标蛋白的纳米抗体、穿膜肽和溶酶体分选序列三部分组成,GlueTAC共价结合目标蛋白后在穿膜肽和溶酶体分选序列的作用下,通过网格蛋白介导的内吞将目标蛋白运送到溶酶体并降解。第一个GlueTAC由北京大学的陈鹏教授报导,可成功降解肿瘤细胞表面的PD-L1,在小鼠身上表现出比阿替丽珠单抗更强的抗肿瘤效果。GlueTAC分子虽然表现出较强的降解能力,但纳米抗体中引入了非天然氨基酸并与目标蛋白形成共价键,还需要仔细评估这一改造对靶细胞和非靶细胞的毒性。此外,纳米抗体没有Fc片段,不能与FcRn结合并循环利用,其体内半衰期也有待确定。
AUTAC[2]
自噬靶向嵌合体(autophagy-targeting chimera, AUTAC)由降解标签、linker以及目标蛋白的配体三部分组成,其通过降解标签模拟S-鸟苷酸化修饰,诱导目标蛋白的多聚泛素化,进而招募自噬体实现溶酶体途径降解。东北大学的Arimoto在2019年首次提出AUTAC的概念,他们将鸟苷酸衍生物(FBnG)与目标蛋白配体连接,通过自噬-溶酶体途径有效实现了对甲硫氨酸氨基肽酶2(MetAP2)、BET家族蛋白等多种疾病蛋白的降解,并且还成功实现了碎片化线粒体的降解,在线粒体功能障碍等相关的疾病上有巨大的应用潜力。相比PROTAC,AUTAC的降解速度略慢,一般PROTAC降解耗时约1h,而AUTAC降解需数小时,这也是AUTAC在未来发展中可以提升的地方。
ATTEC和AUTOTAC [2]
自噬体束缚化合物(autophagosome-tethering compound, ATTEC)可同时结合目标蛋白与LC3蛋白(自噬小体形成融合过程的关键蛋白),启动目标蛋白的自噬过程并被溶酶体降解。目前报道的ATTEC均为高通量筛选得到的小分子化合物,结构也较为简单。复旦大学的鲁伯埙教授报道了可通过自噬途径降解突变亨廷顿蛋白及细胞内脂滴的小分子ATTEC,并已在动物模型上验证了降解能力。相比PROTAC,ATTEC出现耐药的概率进一步降低,且成药性大大提高,但目前开发筛选成本较高,还无法对其进行合理设计,此外ATTEC对细胞整体的自噬活性有何影响也许进一步探究,目前还未有化合物进入临床。自噬靶向嵌合体(autophagy-targeting chimera, AUTOTAC)分子由三部分组成:目标蛋白的配体、linker、可启动自噬的p62蛋白的配体。AUTOTAC同时结合目标蛋白和p62的ZZ结构域,并促进p62的寡聚化和活化,使目标蛋白通过自噬-溶酶体途径降解。AUTOTAC不仅可以介导雄激素受体等单体蛋白的靶向降解,还能介导与阿尔兹海默相关的聚集性Tau蛋白的降解,这一点便是AUTOTAC相比PROTAC的优势所在,为蛋白降解领域提供了一个针对聚集性蛋白的新策略。
基于CMA的降解剂[2]
基于CMA(Chaperone-MediatedAutophagy)的降解剂(CMA-baseddegrader)由CMA靶向序列、细胞穿透肽和目标蛋白配体序列三个部分组成,其化学本质为多肽,目标蛋白配体序列可以识别并结合胞内蛋白,CMA靶向序列则可结合热休克蛋白70并启动分子伴侣介导的自噬过程,将目标蛋白运送到溶酶体降解。目前,这种技术已被证明可以降低突变亨廷顿蛋白、死亡相关蛋白激酶1以及α-突触核蛋白的水平,但多肽稳定性、递送效率等问题还有待进一步解决。近几年来,TPD药物开发领域发展迅猛,2019年,由Arvinas开发用于治疗前列腺癌的ARV-110成为第一个进入临床的PROTAC,其后3年间又有超过10个PROTAC及分子胶也开始人体试验,绝大部分的适应症集中在肿瘤领域,2021年12月,Arvinas披露了ARV-471治疗晚期乳腺癌的I期临床数据,在700mg剂量下仍未达到最大耐受剂量且未观察到剂量限制性毒性,证明了ARV-471良好的安全性,该分子将在今年进入III期临床。
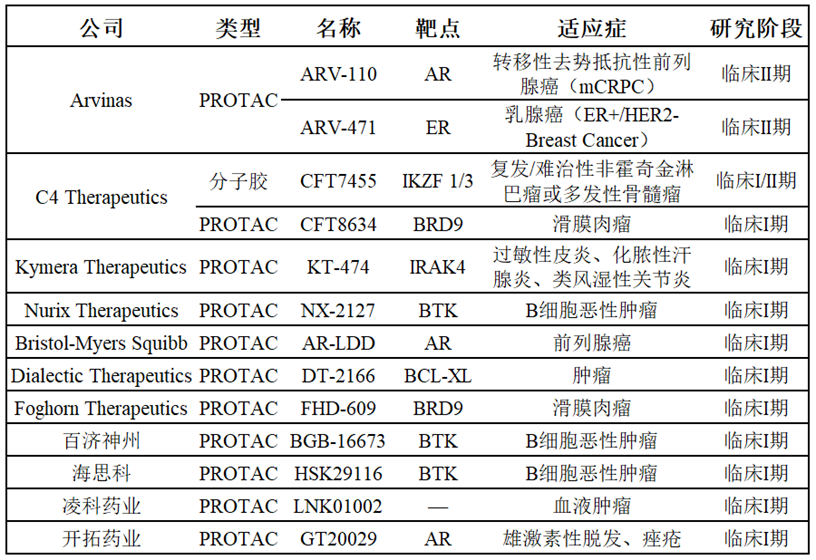
临床阶段的TPD技术[12]
除了应用于肿瘤领域,TPD药物在治疗神经退行性疾病、炎症性疾病及病毒感染方面也有着巨大潜力。Kymera公司目前正在开展PROTAC用于治疗类风湿性关节炎、过敏性皮炎的I期临床,Accutar用于自免疾病的PROTAC也已进入IND申报阶段。此外,目前仍处于临床前阶段的溶酶体靶向降解技术,如ATTEC、LYTAC、AUTAC等也已在动物模型上实现了对阿尔兹海默、亨廷顿舞蹈症、丙型肝炎等疾病相关蛋白的成功降解,假以时日,他们的治疗潜力也终将兑现,当然,在此之前,TPD药物仍有一些挑战等待克服。PROTAC药物分子量普遍较大,超过700 Da,生物膜透过性不佳,可能导致药物生物利用度低而不能发挥药效;分子胶在成药性方面优势明显,但尚无法合理设计,仅能通过大规模筛选得到,与此同时E3泛素连接酶的丰富性也有待提高,目前只有VHL、CRBN、IAP和MDM2等少数E3连接酶被用于目标蛋白降解,这显然覆盖不到所有疾病相关蛋白。而对于基于溶酶体的TPD技术来说,虽然有着比PROTAC等基于泛素TPD更广阔的应用场景,但目前的发展刚刚起步,尚未有进入临床的化学实体,更多的作用机制和对细胞、组织的整体影响有待阐明,例如,占用溶酶体进行蛋白降解是否会影响细胞的新陈代谢。此外,多肽、抗体小分子偶联物等化学实体也同样存在着膜渗透性的限制,需要通过一定的递送技术来提高其降解效果。虽然存在着这样那样的限制和挑战,但TPD技术可降解的目标蛋白库十分丰富,其仍然是未来药物开发最具潜力的领域之一,将为解决未满足临床需求带来巨大希望。 主要参考文献
主要参考文献
[1] Eldridge, A., O'Brien, T. Therapeuticstrategies within the ubiquitin proteasome system. Cell Death Differ 17, 4–13(2010).[2] Zhao, L., Zhao, J., Zhong, K. et al. Targetedprotein degradation: mechanisms, strategies and application. Sig TransductTarget Ther 7, 113 (2022).[3] Chamberlain, P.P., Hamann, L.G. Development of targetedprotein degradation therapeutics. Nat Chem Biol 15, 937–944 (2019).[4] Yang, Z., Sun, Y., Ni, Z. et al. Merging PROTACand molecular glue for degrading BTK and GSPT1 proteins concurrently. Cell Res31, 1315–1318 (2021).[5] Ding Y, Fei Y, Lu B. Emerging New Concepts ofDegrader Technologies. Trends Pharmacol Sci. 41(7):464-474 (2020).[6] Banik, S.M., Pedram, K., Wisnovsky, S. et al.Lysosome-targeting chimaeras for degradation of extracellular proteins. Nature584, 291–297 (2020).[7] Miao, Y. et al. Bispecific aptamer chimerasenable targeted protein degradation on cell. Membr. Angew. Chem. Int Ed. Engl.60, 11267–11271 (2021).
[8] Cotton AD et al. Development of Antibody-BasedPROTACs for the Degradation of the Cell-Surface Immune Checkpoint ProteinPD-L1. J Am Chem Soc. 20;143(2):593-598. (2021).[9] Zhang H et al. Covalently Engineered NanobodyChimeras for Targeted Membrane Protein Degradation. J Am Chem Soc.13;143(40):16377-16382. (2021)[10] Takahashi, D. et al. AUTACs: cargo-specificdegraders using selective autophagy. Mol. Cell 76, 797–810 e710 (2019).[11] Nakatogawa, H. Mechanisms governingautophagosome biogenesis. Nat. Rev. Mol. Cell Biol. 21, 439–458 (2020).[12] https://pharmaintelligence.informa.com/

 EN
EN
